动物疫病检测���,作为健康养殖的关键一环���,在整体疫病预防控制中发挥着关键作用���,具有提前预警评估风险���,有效预防和减少疾病的发生等价值。为支持客户精准防控���,健康养殖���,尊龙凯时引进了宋庆庆博士���、涂亚斌博士���、刘春国博士���、李秋博士等一批青年科学家���,致力于将更多新颖想法与研究成果融入到产品研发和生产实践中���,从而有效带动尊龙凯时的技术水平实现不断提高与突破。
近年来���,尊龙凯时疫病检测实力不断提升���,建有CNAS标准实验室���,现有30余位检测精英���,配备110余台(套)仪器和设备���,年检测样本14万余份。在刘春国博士的带领和培养下���,尊龙凯时检测人才迅速成长���,并于近日在国际家禽领域top期刊《家禽科学》上发表了以王雪博士为第一作者���,刘春国博士为通讯作者的最新研究成果“同时检测MG ts-11疫苗株和非ts-11株的Cycleave双探针荧光定量PCR方法的开发和应用”(http://doi.org/10.1016/j.psj.2024.103907)。该研究建立的cycleave双探针荧光定量PCR方法具有良好的特异性���、敏感性和重复性���,为MG ts-11疫苗株和非ts-11株的快速高效鉴别诊断提供了有力的技术支撑。
以下为论文发表全文
同时检测MG ts-11疫苗株和非ts-11株的Cycleave双探针荧光定量PCR方法的开发和应用
王雪���,孙娜娜���,王猛���,王慧���,刘雨涵���,石豪���,朱浩���,李培东���,张富友���,杨天耀���,李朝阳���,刘春国
摘要���:鸡败血支原体(MG)ts-11活疫苗已成为预防和控制MG感染的有效方法。然而���,ts-11株通常难以与非ts-11株���,包括野毒株和其他疫苗株(F和6/85)进行区分。因此���,建立一种快速有效的方法来区分ts-11株和非ts-11株至关重要。根据ts-11株pot C基因中存在一个单点突变的保守区域���,我们设计一对引物及鉴别疫苗毒和野毒的两条探针。该方法能够准确���、高效地鉴别ts-11和非ts-11株���,最低检测限分别为2.43拷贝/μL和1.6拷贝/μL。此外���,该方法也具有良好的特异性���,禽流感病毒���、传染性支气管炎病毒���、新城疫病毒���、禽腺病毒���、传染性喉气管炎病毒���、传染性法氏囊病病毒���、鸡贫血病毒���、马立克氏病病毒���、滑液囊支原体和鼻气管鸟杆菌检测结果均为阴性。临床样品检测结果表明���,该方法可有效进行ts-11和非ts-11株的混合感染或单一感染的检测区分���,而且批内和批间变异系数较低。本研究建立的cycleave双探针荧光定量PCR方法具有良好的特异性���、敏感性和重复性���,为MG ts-11和非ts-11株的快速高效鉴别诊断提供了有力的技术支撑。
关键词���:鸡败血支原体(MG)���,cycleave荧光定量PCR���,鉴别诊断���,ts-11株
引言
目前���,已知有约23种支原体存在于鸟类中。其中���,最主要和最常见的感染鸡的支原体包括鸡败血支原体(MG)和滑液囊支原体(MS)(Dhondt等���,1998; Ross等���,2014)。MG是鸡和其他禽类(Wang等���,2022)慢性呼吸道疾病(CRD)的主要病原体。由于MG感染后可对家禽养殖业造成重大的经济损失���,MG被认为是影响家禽(Mugunthan等���,2023)经济价值的最主要的致病性支原体。MG感染呈全球分布���,已被世界动物卫生组织(WOAH)所收录。MG可导致火鸡传染性鼻窦炎���,北美雀类结膜炎。MG也可引起一些鸟类发病���,包括美国金雀���、紫雀和麻雀���,以及一些观赏性鸟类���,包括雉类���、鹧鸪和石鸡(Mugunthan等���,2023)。在鸡群中���,MG不仅引起CRD���,还可与大肠杆菌和低致病性禽流感病毒等协同感染���,引起呼吸道疾病(Naylor等���,1992)。由于MG在禽类中具有较高的致病性���,给养殖业造成了巨大的经济损失���,因此���,提高MG的诊断和防治水平至关重要。
MG可以水平传播和垂直传播。水平传播主要通过飞沫���、唾液���、携带MG的气溶胶以及被污染的饲料和饮用水;通过鸡胚的垂直传播偶尔发生。鸡群中MG感染很难彻底清除���,导致MG感染在鸡群中长期存在并广泛传播���,使得MG感染的防控更加困难。
疫苗免疫是预防MG感染的重要策略。目前���,6/85���、ts-11和F株是世界范围内使用的主要活疫苗株。F菌株毒力强���,对肉鸡和火鸡均有致病性。6/85株和ts-11株是非常安全的���,对未免疫鸡群的潜在传播风险较低(Noormohammadi and Whithear���,2019; Vance等���,2008)。ts-11疫苗由澳大利亚生物资源公司研制(Whithear等���,1990)。ts-11株的最适生长温度为33℃���,相关研究表明在39.5℃时疫苗株增殖能力下降���,说明ts-11株对温度敏感。与亲本株(80083株)相比���,ts-11株高度致弱���,可能对鸡无致病性。此外���,ts-11株在鸟类间的水平传播能力也较低。研究表明���,ts-11疫苗对MG强毒株引起的呼吸道疾病和产蛋下降具有保护作用(Armour and Ferguson-Noel���,2015)。相反���,F株能够在肉鸡中传播并引起呼吸道症状(Vance等���,2008; Rodriguez and Kleven���,1980)。随着ts-11疫苗的广泛使用���,区分疫苗株与非疫苗株已成为养殖业的迫切需求。常规的病原体分离培养方法无法有效区分疫苗株和非疫苗株。目前���,我国缺乏直接���、快速���、灵敏和定量的方法来评估疫苗免疫后ts-11株的定植情况(Sulyok等���,2019)。因此���,建立有效的检测方法来区分MG ts-11株与非ts-11株是控制MG感染的关键。
Cycleave荧光PCR已应用于畜牧业���、兽医以及布病和肺癌等人类疾病的研究(Fujita等���,2015; Nan等���,2016)。该方法不同于传统的荧光定量PCR���,它结合循环探针技术提高了特异性。Cycleave PCR检测可以实时检测单核苷酸多态性。利用嵌合RNA-DNA 探针和RNase H来检测目标核苷酸。嵌合探针含有一个RNA碱基���,当探针与互补DNA序列形成杂合体时���,该碱基可以被RNase H切割���,探针裂解发出荧光信号。如果探针的RNA部分或一个RNA碱基与模板不匹配���,RNase H 无法切割探针的RNA部分。在本研究中���,开发了一种cycleave双探针荧光定量PCR(cycleave qPCR)方法来区分MG ts-11株和非ts-11株。利用RNA和DNA杂合循环探针���,RNase H���,以及针对性引物���,可以高效���、准确地鉴别ts-11株和非ts-11株。该方法可在1小时内鉴定出目标株���,从而实现MG的快速检测以及ts-11疫苗株与非ts-11株的快速鉴别诊断。
材料与方法
病原
鸡传染性支气管炎病毒(IBV)���、新城疫病毒(NDV)���、禽流感病毒(AIV)���、禽腺病毒(FAdV)���、传染性喉气管炎病毒(ILTV)���、传染性法氏囊病病毒(IBDV)���、鸡贫血病毒(CAV)���、马立克氏病病毒(MDV)���、MS和鼻气管鸟杆菌(ORT)等均由山东尊龙凯时股份有限公司检测中心保存。所有病毒及MS和ORT均采用特异性PCR方法进行鉴定。
引物和探针
研究表明���,pot C基因可作为鉴别ts-11疫苗株与野毒株(Sulyok等���,2019)的靶基因。从GenBank下载ts-11株 (CP044225.1)和代表性非ts-11株(野生型(CP006916.3)���、6/85(CP044224.1)和F株(NC017503.1))的pot C基因序列。利用Snap Gene软件(version 3.1.4)针对ts-11株pot C基因中含有单点突变的保守区域设计引物。采用金斯瑞qPCR(TaqMan)在线引物设计软件设计探针(http://www.genscript.com/tools/real-timepcr-taqman-primer-design-tool)。所用引物和探针由宝生物工程(大连)有限公司合成���,见表1。
表1 引物和探针序列
核酸提取及重组质粒的制备
使用VNP-32P全自动核酸提取仪和诺维赞DNA/RNA提取试剂盒提取AIV���、IBV���、NDV���、FAdV���、ILTV���、IBDV���、CAV���、MDV���、MS���、ORT和所有拭子样品的核酸。重组质粒pts-11和pnon-ts-11分别克隆有ts-11株和非ts-11株的pot C部分基因���,由宝生物工程(大连)有限公司合成。
Cycleave qPCR反应程序
Cycleave qPCR反应体系为25 μL���,包括12.5 μL的Cycleave PCR Mix(2×Conc.)���,上游引物(10 μM)和下游引物(10 μM)各0.5 μL���,ts-11探针(5 μM)和非ts-11探针(5 μM)各1 μL���,模板2 μL���,灭菌水7.5 μL。反应条件为95℃预变性30s;95℃变性10s���,60℃退火30s���,72℃延伸20s���,共40个循环。延伸时进行荧光信号检测���,根据扩增曲线和Ct值判断结果。qPCR使用Roche Light Cycler 480进行。以200 RFU的荧光信号作为cycleave qPCR检测的阈值���,Ct≤36判为阳性。
标准曲线的建立
用微量分光光度计测定pts-11和pnon-ts-11重组质粒的浓度���,并计算各自的拷贝数。然后将质粒在无菌水中进行10倍倍比稀释(108~103)���,作为cycleave qPCR的模板。每个稀释度重复3次���,建立标准曲线。反应体系和程序同上���,利用软件计算标准曲线参数���,包括效率���、斜率和R2。
特异性���、敏感性和重复性分析
为了验证特异性���,以提取的AIV���、IBV���、NDV���、FAdV���、ILTV���、IBDV���、CAV���、MDV���、MS和ORT基因组为模板���,进行cycleave qPCR扩增。并用104稀释的pts-11和pnon-ts-11质粒作为阳性对照���,无菌水作为阴性对照。
为了检测cycleave qPCR的敏感性���,将两个质粒分别做102~1011连续稀释���,作为cycleave qPCR和常规PCR的模板���,以无菌水作为阴性对照。为了确定cycleave qPCR的重复性和稳定性���,将pts-11和pnon-ts-11质粒10倍倍比稀释(104~106)作为cycleave qPCR的模板;在批内和批间重复试验中���,每个样品设置3个重复。批间重复试验的时间间隔为1周。根据公式CV =(SD [ Ct值] /总体平均值[ Ct值])×100计算变异系数(CV)。
临床样品检测
采集2022年山东���、黑龙江和广东三省免疫MG ts-11疫苗35天后的10个规模化鸡场的鸡上颚裂拭子300份。样品的采集经山东尊龙凯时股份有限公司实验动物管理与伦理委员会批准(QXRZ���:2021-007)。利用建立的Cycleave qPCR方法进行检测���,同时与商品化MG通用qPCR试剂盒(英赛特)的检测结果进行比对。此外���,从两个饲养和管理条件相似���,但MG疫苗免疫程序不同的大型养殖场采集临床样本���,以评估免疫效力。
结果
标准曲线的建立
根据检测结果绘制ts-11株和非ts-11株的标准曲线���,见图1和表2。斜率分别为-3.303和-3.410���,R2值分别为0.9993和0.9987���,扩增效率分别为100.8%和98.4%。ts-11株批内重复性CV为0.32%~0.82%���,非ts-11株批内重复性CV为0.91%~1.13%。此外���,ts-11株批间重复性CV为0.40%~0.51%���,非ts-11株批间重复性CV为0.63%~0.95%(表3)。
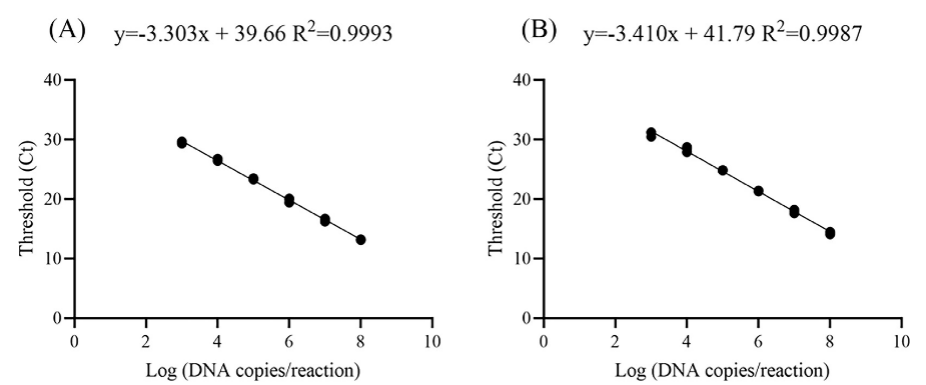
图1. Cycleave qPCR标准曲线。ts-11株质粒pts-11从2.43×103倍比稀释到2.43×108拷贝/mL(A);非ts-11株质粒pnon-ts-11从1.65×103倍比稀释到1.65×108拷贝/mL(B)。
表2 Cycleave qPCR标准曲线结果
Cycleave qPCR方法的特异性���、敏感性和重复性
选取AIV���、IBV���、NDV���、FAdV���、ILTV���、IBDV���、CAV���、MDV���、MS和ORT等常见鸡源病原���,对建立的cycleave qPCR方法进行特异性验证。结果显示���,与阴性对照相同���,这些病原cycleave qPCR检测结果均为阴性(图2)。
图2. Cycleave qPCR特异性评估。ts-11疫苗株(A);非ts-11株(B)。P���:阳性对照;A���:AIV;B���:IBV;C���:NDV;D���:FAdV;E���:ILTV;F���:IBDV;G���:CAV;H���:MDV;I���:MS;J���:ORT;N���:阴性对照。
将质粒进行10倍倍比稀释���,根据质粒拷贝数评估cycleave qPCR检测方法的敏感性。结果表明���,ts-11株(图3A)和非ts-11株(图3B)的cycleave qPCR敏感性分别为2.43拷贝/μL和1.65拷贝/μL。常规PCR方法对ts-11疫苗株(图4A)和非ts-11株(图4B)的敏感性分别为2.43×103拷贝/μL和1.65×103拷贝/μL。cycleave q PCR方法的敏感性比常规PCR方法高1000倍。
图3. Cycleave qPCR敏感性评估。ts-11株质粒pts-11从102倍比稀释到1010(A);非ts-11株质粒pnon-ts-11从102倍比稀释到1010(B)。N���:阴性对照。
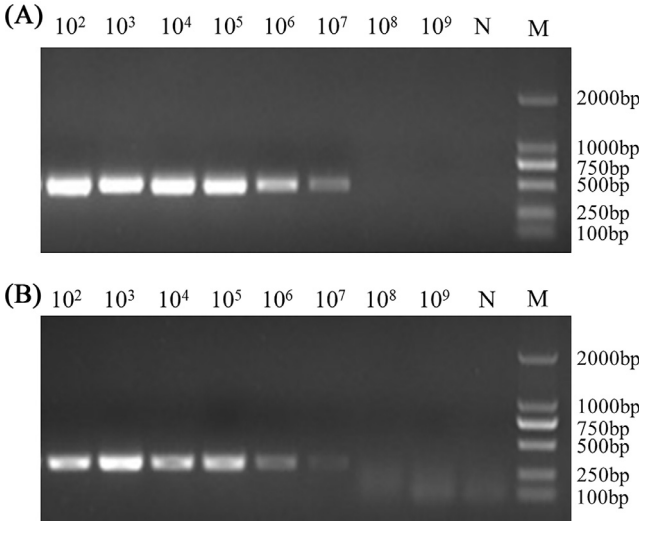
图4. 普通PCR检测ts-11株和非ts-11株电泳图。ts-11株质粒pts-11从102倍比稀释到1010(A);非ts-11株质粒pnon-ts-11从102倍比稀释到1010(B)。N���:阴性对照;M���:DNA标准。
为评价cycleave qPCR的重复性和稳定性���,进行批内和批间重复性试验���,所有cycleave qPCR均重复3次���,计算Ct和CV的平均值。结果显示���,ts-11株批内重复性CV为0.32%~0.82%���,非ts-11株批内重复性CV为0.91%~1.13%。此外���,ts-11株的批间重复性CV为0.40%~0.51%���,非ts-11株的批间重复性CV值为0.63%~0.95%(表3)。
表3 Cycleave qPCR批内和批间重复性实验结果
临床样品检测
共采集300份免疫ts-11株35天后的鸡上颚裂拭子。ts-11株阳性率为70% (210/300)���,非ts-11株阳性率为20%(60/300)���,其余30份检测结果均为阴性���,与商品化MG通用qPCR检测试剂盒的结果一致性为100%。
A公司分别在25日龄和45日龄免疫一次ts-11疫苗���,B公司仅在21日龄免疫ts-11疫苗。在免疫后不同时间采集上颚裂拭子���,利用建立的cycleave qPCR方法评价免疫效果。结果显示���,两次免疫的效果(图5A)优于一次免疫的效果(图5B)。
图5. MG ts-11疫苗免疫后不同时间阳性率。A公司在25日龄和45日龄分别免疫一次(A);B公司在21日龄免疫一次(B)。
讨论
MG ts-11的疫苗于1988年首次在澳大利亚上市���,推广20余年���,在全球60多个国家应用 (Ley等���,1997; Muneta等���,2008; Noormohammadi and Whithear, 2019)。该疫苗可持续定植于上呼吸道���,阻止野毒株入侵���,保护关节和输卵管���,提高鸡蛋品质(Vance等���,2009 ; Jacob等���,2015)。然而���,普通方法无法准确区分ts-11株与非ts-11毒株���,因此���,难以了解MG在鸡群中的流行状态���,特别是免疫过MG ts-11疫苗并且发生MG野毒感染的鸡群。由于缺乏准确快速的检测方法���,极大地限制了区分疫苗株和非疫苗株���、评估临床免疫效果���、监测鸡群健康以及预防和控制MG感染的能力。
目前MG的诊断主要依靠分离培养���、抗体检测���、分子生物学检测 (Feberwee等���,2022)。分离培养是检测MG的金标准���,但致病性MG是一种生长缓慢且对培养条件相对苛刻的微生物���,可能需要长达3周的时间才能检测出来。PCR方法具有特异性强���、灵敏度高���、快速���、简便���、价格相对低廉等优点���,可用于直接检测临床样本而不需要分离培养(Leurs等���,2022)。
为了区分ts-11株和非ts-11株���,科学家们进行了许多研究。Raviv等开发了5种qPCR方法���,可将3种商品化疫苗株和2种实验室候选疫苗株(F���,ts-11���,6/85���,K5831和K5054)与野毒株(Rlow)进行区分。然而���,该方法的适用性有限���,无法在更多场合中使用(Raviv等���,2008)。DNA指纹图谱分析方法需要纯培养���,重复性低���,操作步骤冗长���,且缺乏实验室间的比对数据(Hong等���,2005 ; Naziri等���,2016 ; Mateen等���,2021)。熔解曲线法和基于琼脂糖凝胶的错配扩增突变检测法(MAMAs)���,可区分MG疫苗株和野毒株。然而���,由于该检测灵敏度适中���,DNA载量较低的临床样本可能会产生假阴性结果(Sulyok等���,2019)。
因此���,需要开发一种简单���、快速���、灵敏度高���、特异性强的检测方法。特别是对于单碱基突变���,常规PCR无法进行区分���,解决当前的鉴别难题。本研究开发的cycleave qPCR���,探针为循环探针���,它是一种由RNA和DNA组成的杂合探针���,当与RNase H共同使用时���,该方法表现出高度灵敏性和特异性。当探针与互补的DNA序列形成杂合体时���,可以被RNase H切割���,解除淬灭抑制���,促进荧光物质发出荧光(Yamada等���,2021)。通过测量荧光强度可以实时对产物进行监测。因此���,这是一种高度特异性的检测方法���,即使只有一个碱基的变化也能识别差异。与传统的荧光PCR相比���,该探针一般由大约12个碱基组成���,荧光报告基团与淬灭基团接近���,淬灭效果好���,荧光背景低���,信噪比高。
本研究建立的cycleave qPCR方法可在1 h内特异性区分ts-11株和非ts-11株���,与AIV���、IBV���、NDV等常见禽病病原无交叉反应。Cycleave qPCR具有较高的敏感性���,对ts-11株的检测极限为2.43拷贝/μL���,对非ts-11株的检测极限为1.65拷贝/μL。批内和批间CV均小于1.13%。在临床样品检测中���,cycleave qPCR与商品化MG通用qPCR试剂盒的一致性为100%���,可有效评价MG ts-11疫苗在鸡群中的免疫效果。需要说明的是���,该方法只能区分ts-11疫苗株和非ts-11疫苗株���,包括野毒株和其他疫苗株(F和6/85)。如果需要区分疫苗株(包括ts-11���、F和6/85)和野生株���,建议联合使用其他方法。
综上所述���,本研究建立了cycleave双探针荧光定量PCR方法。该方法操作简单���、灵敏度高���、特异性强���、重复性好���、效率高。尤其是该方法可以同时检测MG ts-11株和非ts-11株。目前���,ts-11活疫苗是主要的MG疫苗���,在我国应用广泛���,在MG防控的临床实践中发挥了重要作用。Cycleave qPCR的建立将极大地促进MG ts-11活疫苗的应用和MG感染的防控���,已在临床上得到证实。在我国���,从商品鸡群中根除MG的计划已经提上了日程���,本研究建立的cycleave qPCR方法将在MG感染的流行病学监测中发挥重要作用。